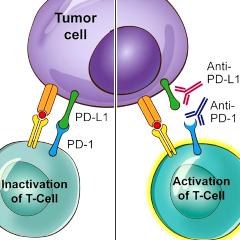
Il s'agit du premier traitement d'immunothérapie approuvé pour le cancer du sein.
Dans une étude publiée en octobre 2018 dans le New England Journal of Medicine, chez les femmes ayant reçu le traitement, la médiane de survie sans aggravation de la maladie a été de 7,4 mois, contre 4,8 mois chez celles ayant reçu la chimiothérapie avec un placebo.
Les effets indésirables les plus fréquents (signalés chez plus de 20 % des patientes) étaient la perte de cheveux, les neuropathies périphériques, la fatigue, la nausée, la diarrhée, l'anémie, la constipation, la toux, les maux de tête, la neutropénie, les vomissements et la baisse d'appétit.
-
Cancer : l'efficacité de 2 types d'immunothérapie comparée à celle des autres médicaments
-
Le Nobel de médecine 2018 porte sur le traitement du cancer par immunothérapie
Pour plus d'informations sur le cancer du sein et sur l'immunothérapie, voyez les liens plus bas.
Psychomédia avec source : FDA.
Tous droits réservés









