Ces résultats valident l'idée de médicaments de précision, sur laquelle travaillent plusieurs compagnies pharmaceutiques afin de traiter les cancers en acheminant les médicaments cytotoxiques (qui inhibent la fonction des cellules) directement aux cellules tumorales, épargnant ainsi les cellules saines, ce qui permet des doses plus puissantes et réduit les effets secondaires.
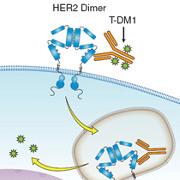
Le médicament, un conjugué anticorps-médicament, est une combinaison de l'anticorps monoclonal trastuzumab (Herceptin), qui cible les récepteurs HER2, et de l'agent de chimiothérapie DM1.
Kimberly Blackwell du Duke Cancer Institute et ses collègues ont mené cette étude avec près de 1000 femmes ayant reçu le Herceptin combiné au Paclitaxel (qui vise à empêcher la division cellulaire des tumeurs) mais n'y répondant plus. Elles ont été assignées au hasard à recevoir le T-DM1 ou une combinaison de capécitabine (Xeloda) et de lapatinib (Tykerb).
La médiane de survie sans progression de la maladie était de 9,6 mois avec le T-DM1 comparativement à 6,4 mois avec le Xeloda-Tykerb. Le médicament présentait aussi moins d'effets secondaires tels que la perte de cheveux. Après deux ans, 65,4% des participantes ayant été traitées avec le T-DM1 étaient encore en vie comparativement à 47,5%.
Les recherches sur des conjugués anticorps-médicaments pour le traitement de divers cancers se poursuivent depuis des décennies et connaissent leurs premiers succès, indique le New York Times. L'Adcetris a été approuvé l'an dernier pour le traitement de deux types rares de lymphomes et environ 25 conjugués seraient actuellement en cours d'essais cliniques.
Roche prévoit déposer cette année une demande d’autorisation de mise sur le marché (AMM) à l’Agence européenne des médicaments (EMA) et sa filiale Genentech fera de même auprès de la Food and Drug Administration (FDA) aux États-Unis. Le médicament pourrait ainsi être disponible l'année prochaine.
Psychomédia avec sources: USA Today, New York Times. Tous droits réservés.










