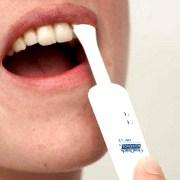
La Food and Drug Administration (FDA) américaine a autorisé, mardi 3 juillet, la vente libre du test de dépistage de l'infection au virus de l'immunodéficience humaine (VIH) OraQuick In-Home HIV du laboratoire américain OraSure Technologies.
Ce test est identique à celui utilisé depuis des années par les médecins sous le nom de marque OraQuick Advance HIV 1/2 Antibody test. Il fournit un résultat en 20 à 40 minutes à partir d'un échantillon de salive. Il sera en vente libre à partir d'octobre aux États-Unis.
Dans un essai clinique, il permettait de détecter une infection par le VIH dans 92 % des cas et l'absence d'infection dans 99 % des cas.
Onusida a salué cette décision. "Il est désormais possible de casser le cycle de la stigmatisation et de la discrimination qui empêche les gens de connaître leur état sérologique vis-à-vis du VIH
", a déclaré son directeur exécutif, Michel Sidibé. Le Royaume-Uni soutient également la légalisation des kits de dépistage du VIH à domicile. En septembre 2011, la commission sur le sida de la Chambre des Lords a recommandé l'abrogation des lois qui interdisent le dépistage du VIH à domicile, rapporte Onu Sida.
En France, où 30.000 à 50.000 personnes ignoreraient leur séropositivité parmi les 150.000 infectés par le virus, un discours paternaliste, selon lequel les gens ne devraient pas être "livrés à eux-mêmes face à un résultat positif
", semble toujours prévaloir. Les tests à domicile sont interdits et seuls peuvent être réalisés, depuis novembre 2010, des tests rapides par des associations habilitées par le ministère de la Santé (comme Aides).
Cette nouvelle autorisation américaine, qui devrait notamment favoriser la disponibilité prochaine de ces tests sur internet, devrait exercer une pression vers l'évolution de cette mentalité. Laquelle a peut-être de moins en moins sa place alors que les consommateurs deviennent mieux en mesure de s'informer et peuvent souhaiter davantage d'autonomie.
Psychomédia avec sources: ONUSida, Le Monde, Le Figaro. Tous droits réservés.










