La Food and Drug Administration (FDA), l'autorité du médicament américaine, a accordé le statut de revue prioritaire pour le médicament Benlysta (belimumab), de GlaxoSmithKline et Human Genome Sciences, pour le traitement du lupus érythémateux disséminé, la forme la plus courante de la maladie.
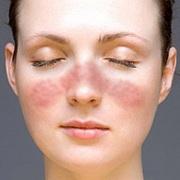
Le lupus est une maladie auto-immune chronique, inflammatoire, qui touche essentiellement la peau et les articulations. Il peut aussi, lorsqu'il est plus sévère, toucher les reins, le coeur, les poumons, le sang et le système nerveux.
Benlysta (belimumab) représenterait la première innovation depuis 50 ans pour le traitement du lupus.
Il est le premier d'une nouvelle classe de médicaments, appelée inhibiteurs BLyS-spécifiques, qui reconnaissent et inhibent l'activité biologique du stimulateur des lymphocytes B, ou BLyS. Dans le lupus, la polyarthrite rhumatoïde et certaines autres maladies auto-immunes, des niveaux élevés de BLyS contribueraient à la production d'auto-anticorps, des anticorps qui attaquent et détruisent les propres tissus de l'organisme.
Psychomédia avec source:
Medical News Today
Tous droits réservés










