Un premier « pancréas artificiel » a reçu une autorisation de mise en marché. Le MiniMed 670G de la société irlandaise Medtronic vient d'obtenir le feu vert de la Food and Drug Administration (FDA) américaine. Il est destiné aux personnes diabétiques de type 1 âgées de plus de 14 ans.
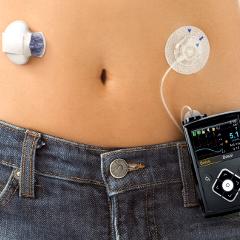
Un pancréas artificiel est un système automatisé constitué d'un capteur sous-cutané mesurant la glycémie en temps réel et d'une pompe à insuline. Un algorithme détermine la quantité d'insuline délivrée par la pompe selon la mesure de la glycémie.
Le capteur sous-cutané est posé au niveau de l'abdomen et la pompe se porte à la ceinture.
Les utilisateurs peuvent ajuster manuellement les doses d’insuline au moment des repas afin d’éviter l'hyperglycémie ou l'hypoglycémie.
« Il s'agit de la première technologie capable d’apporter aux patients diabétiques de type 1 davantage de liberté dans leur vie car ils n’auront plus à surveiller continuellement et manuellement leur glycémie, et à s’administrer de l’insuline », a souligné Jeffrey Shuren, directeur du Centre des dispositifs médicaux de la FDA.
L'agence a demandé au fabricant de mener une étude post-commercialisation afin de collecter des données d’utilisation en vie réelle, et à grande échelle. Le fabricant étudie également l’efficacité et l’innocuité de l’appareil chez les enfants âgés de 7 à 13 ans.
Les premiers pancréas artificiels devraient être commercialisés au printemps 2017.
Un autre pancréas artificiel, le Diabeloop français, est actuellement testé en France et aux États-Unis.
Psychomédia avec sources : FDA, Medtronic.
Tous droits réservés










