Un décret publié vendredi au Journal officiel ouvre la voie à la commercialisation en France de médicaments à base de cannabis ou ses dérivés, en permettant "la délivrance d'une autorisation de mise sur le marché
" (AMM) par l'Agence nationale du médicament (ANSM). Le code de santé publique interdisait l'emploi des dérivés de cannabis, y compris les médicaments qui en contiennent.
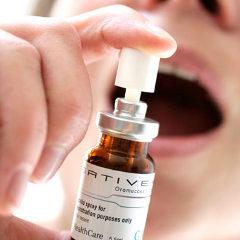
Avec la publication de ce décret, l'ANSM peut étudier un premier dossier, celui du Sativex (nabiximols) du laboratoire Bayer, un médicament sous forme de spray, déjà disponible dans plusieurs pays européens, dont l'Allemagne, la Grande-Bretagne et l'Espagne ainsi qu'aux États-Unis et au Canada.
L'indication thérapeutique de ce médicament concerne des douleurs et contractures sévères et résistantes aux autres traitements chez les personnes atteintes de sclérose en plaques.
Actuellement, en France, seules des autorisations temporaires d’utilisation (ATU) sont délivrées pour le médicament à base de cannabis synthétique Marinol (dronabinol) qui est peu dosé. Depuis 2001, seules une centaine autorisations auraient été accordées sur 150 demandes, indique le Nouvel Observateur.
Un autre médicament de cannabis synthétique proche du dronabinol disponible dans certains pays (dont le Canada) est le nabilone (Césamet) utilisé notamment contre les douleurs chroniques et les nausées causées par la chimiothérapie. Des formes naturelles de cannabis thérapeutique (ou médical) sont aussi disponibles dans certains pays.
Psychomédia avec sources: Le Parisien, Le Monde, Le Nouvel Observateur. Tous droits réservés










