
« Certaines douleurs, provoquées par un accident, une chute ou une opération chirurgicale, disparaissent avec la guérison. Et d’autres, non.
»
Dans une étude publiée dans la revue Nature Communications en mars, des chercheurs français ont « levé une partie du mystère autour de l’origine des douleurs chroniques. Et ouvert la voie vers un éventuel traitement.
»
La douleur aiguë est un mécanisme de défense et de protection générant des comportements visant sa diminution alors que la douleur chronique ne joue plus ce rôle d’alerte et devient en elle-même une maladie chronique, soulignent, dans The Conversation France, Jean Valmier et Cyril Rivat de l'Inserm (Université de Montpellier), coauteurs.
Les douleurs chroniques, expliquent-ils, sont classées en trois catégories :
«
La première concerne les douleurs inflammatoires qui se déclenchent après une agression des tissus et la réponse inflammatoire secondaire à cette agression.La deuxième catégorie est celle des douleurs neuropathiques, conséquences d’une atteinte du système nerveux. Celle-ci peut être causée par un traumatisme accidentel, une intervention chirurgicale, un diabète, un zona, un syndrome du canal carpien ou un traitement anti-cancéreux. Dans cette catégorie, entre également la douleur dite du “membre fantôme”, celle que l’ont ressent comme réelle dans un membre (main, bras, pied ou jambe) alors que celui-ci a été amputé.
La troisième catégorie regroupe les douleurs dysfonctionnelles qui relèvent d’une amplification des signaux douloureux, alors même qu’il n’existe ni inflammation ni atteinte des nerfs. La fibromyalgie en est un exemple – même si cette maladie reste actuellement assez mal définie. »
« Dans les douleurs chroniques neuropathiques, bien souvent la cause initiale a disparu, pourtant la personne continue à souffrir.
» Parmi les douleurs persistantes, les douleurs neuropathiques, dont souffrent quatre millions de Français, sont les plus réfractaires aux traitements actuels, selon les auteurs.
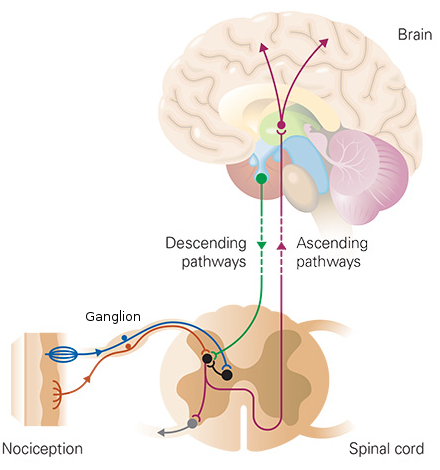
La sensibilisation, mécanisme par lequel la douleur aiguë se transforme en douleur chronique, « est due à certains neurones sensitifs périphériques, ceux qui innervent la peau par exemple. Ils détectent et véhiculent la sensation de douleur. Ces neurones deviennent hyperactifs et fonctionnent durablement de manière aberrante
».
«
Ces neurones, dits somato-sensoriels, sont situés dans les ganglions de la racine dorsale de la moelle épinière, c’est-à-dire le long de la colonne vertébrale. Ils détectent la douleur à l’endroit de la lésion (par exemple, là où la personne a reçu un coup de couteau) et transmettent ces informations aux neurones de la moelle épinière. Ces derniers communiquent à leur tour avec les circuits neuronaux de la perception douloureuse à l’intérieur du cerveau.Qu’est-ce qui provoque la sensibilisation des neurones somato-sensoriels ? Il est clair maintenant que leur interaction avec le système sanguin de défense immunitaire est cruciale. Lors du traumatisme, les cellules immunitaires du sang envahissent le site de la lésion nerveuse. Elles sécrètent, dans cette zone, de nombreuses molécules qui permettent de réparer le tissu mais entraînent également une “hyperexcitation” des neurones sensitifs. »
« Dans leurs travaux publiés dans Nature Communications, les chercheurs montrent que les cellules immunitaires sécrètent la cytokine “FL”, causant la chronicisation des douleurs neuropathiques.
Injecter cette molécule à des rongeurs sains entraîne en effet le développement de symptômes identiques à ceux observés chez l’Homme. On constate des hyperalgies, c’est-à-dire des sensations douloureuses amplifiées, et des allodynies, c’est-à-dire des sensations douloureuses pour des stimuli qui, en temps normal, ne sont pas douloureux. »
Les chercheurs ont « également établi que FL se fixe sur son récepteur FLT3 situé dans le neurone sensitif ; et que cette liaison entre FL et FLT3 déclenche la cascade d’évènements à l’origine de la chronicisation.
»
Le blocage de FLT3 enlevait les douleurs chez l’animal, et ceci de manière durable.
«
Actuellement, les seules molécules inhibant l’activation de FLT3 sont utilisées dans des maladies du sang, les leucémies myéloïdes aiguës. Mais elles ne peuvent être administrées au long cours en raison d’effets secondaires trop graves.L’équipe de chimistes dirigée par Didier Rognan à l’université de Strasbourg a passé au crible, informatiquement, trois millions de configurations possibles pour un futur médicament actif. Les chercheurs ont identifié une molécule anti-FLT3, nommée BDT001, ciblant le site d’accrochage de FL. Cette molécule bloque la liaison entre FL et FLT3, empêchant ainsi les événements conduisant à la douleur neuropathique de s’enchaîner.
Administrée à des modèles animaux, la molécule BDT001 réduit, dans un délai de trois heures, les symptômes douloureux neuropathiques. L’effet persiste 48 heures après une seule administration. »
« Avant de devenir vraiment un médicament, la molécule BDT001 devra encore franchir plusieurs étapes qui prendront au moins 5 années. Il reste en effet à étudier son effet “anti-chronicisation” de la douleur chez l’Homme.
»
Sur The Conversation France : Douleur chronique : pourquoi elle persiste, même quand la cause a disparu.
-
Trois types de douleur chronique selon les mécanismes qui les causent
-
Fibromyalgie : les symptômes qui indiquent la présence probable d'une neuropathie parfois traitable
Pour plus d'informations, voyez les liens plus bas.
Psychomédia avec source : Nature Communications.
Tous droits réservés.










