 La Fampridine en attente d'approbation en Europe et au Canada (janv. 2010)
La Fampridine en attente d'approbation en Europe et au Canada (janv. 2010)Le médicament oral Ampyra (dalfampridine), produit par Elan et distribué par Acorda Therapeutics, vient de recevoir une autorisation de mise en marché de la Food and Drug administration (FDA) américaine pour l'amélioration de la marche chez les personnes atteintes de sclérose en plaques. Le médicament est aussi connu sous les noms Ampriva (Fampridine-SR), Amaya (Fampridine-SR) et 4-aminopyridine.
L'autorisation se base sur les données d'essais cliniques montrant que le médicament améliore la vitesse de la marche chez les personnes atteintes de la maladie. Il s'agit du premier médicament approuvé aux États-unis pour cette indication. Les médicaments actuellement approuvés sont indiqués pour diminuer les taux de rechutes ou dans certains cas pour prévenir l'accumulation de handicaps.
Le médicament peut causer des convulsions chez les personnes qui dépassent le dosage recommandé, de 10 mg deux fois par jour, ou celles qui ont une maladie des reins modérée à sévère.
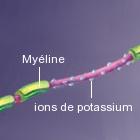
La fampridine n'agit pas sur le processus de démyélinisation mais contribue à améliorer la transmission de l'influx nerveux en agissant sur les canaux à ions de potassium qui servent de barrière à la surface des cellules nerveuses et régulent l'activité électrique.
Les effets secondaires indésirables les plus fréquemment rapportés dans ces essais cliniques ont été les infections des voies urinaires, insomnie, étourdissements, maux de tête, nausée, faiblesse, douleurs dorsales, trouble de l'équilibre, l'enflure du nez ou de la gorge, constipation, diarrhée, indigestion, maux de gorge ainsi que de brûlure, picotement démangeaisons de la peau.
Psychomédia avec sources: Medpage Today, Science Daily, Medscape










